MnO2和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:
①将软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
②除去反应混合物中的不溶物;
③电解混合物:MnSO4+ZnSO4+2H2O
 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法错误的是
| A.干电池是一种将化学能转变为电能的装置 |
| B.步骤③电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+ |
| C.步骤①每析出12.8g S沉淀,共转移0.8mol电子 |
| D.步骤③的反应也可以设计成原电池 |
下列措施中不能加快固体物质溶解的是()
| A.搅拌 | B.适当加热 | C.将块状固体研细 | D.多加水 |
以下是一些常用的危险品标志,装运浓硫酸的贮运罐应贴的图标是()
A B C D
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是()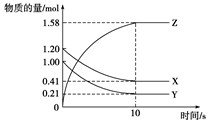
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压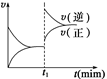
强,速率的变化都符合示意图的反应是()
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
|
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
|
C.H2(g)+I2(g) 2HI(g);ΔH>0 2HI(g);ΔH>0 |
D.2A(g)+B(g) 2C(g);ΔH>0 2C(g);ΔH>0 |
反应A2+B2 2AB在温度和压强改变条件下,产物AB的生成情况如图所示。a为500℃,b为
2AB在温度和压强改变条件下,产物AB的生成情况如图所示。a为500℃,b为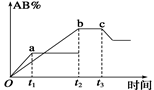
300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙
述正确的是()
| A.A2、B2、AB均为气体,正反应放热 |
| B.AB为气体,A2、B2中最少有一种为非气体,正反应放热 |
| C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热 |
| D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |