归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,C(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0;
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka•Kb=Kw
⑥若反应A(g)="2" B (g) 正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
下列物质中属于氧化物的是
| A.O2 | B.Na2O | C.NaClO | D.FeSO4 |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是



A B C D
有时候,将氧化还原反应方程式拆开写成两个“半反应”。下面是一个“半反应”式:MnO+____H++____e-——____Mn2++____H2O
该反应方程式的配平化学计量数是( )
| A.1,8,4,1,4 | B.2,16,5,2,8 | C.1,6,5,1,3 | D.1,8,5,1,4 |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。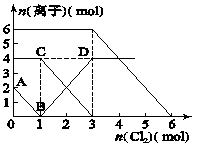
已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。则下列有关说法中,不正确的是( )
| A.原混合溶液中FeBr2的物质的量为6 mol |
| B.线段BD表示Fe3+物质的量的变化 |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。
下列说法正确的是( )
| A.苛性钾溶液中KOH的质量是4.94 g |
| B.反应中转移电子的物质的量是0.09 mol |
| C.氧化性ClO-<ClO |
| D.ClO的生成是由于温度升高引起的 |