工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采
用98.3%的浓硫酸吸收三氧化硫。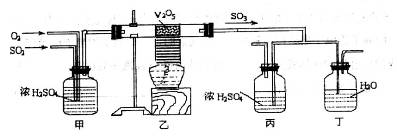
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:____________________________________;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______________、_______________;
(3)丙中的现象为_________________________、丁中的现象为_______________________。
(4)下图是压强对SO2平衡转化率的影响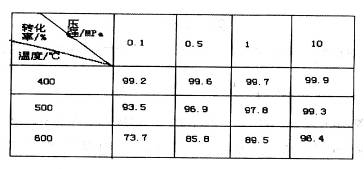
对SO2转化为SO3的反应,增大压强可使转化率________________,只所以通常采用常压操作是因为:____________________。
已知A物质是一种气态烷烃,标况下取22.4L该烃完全燃烧消耗氧气的质量是160g,A的一氯代物有两种同分异构体分别为B和C。各物质转化关系如下图所示:(部分反应物及产物略去)
又知:H不能发生银镜反应,请从反应图式中各物质间的关系,回答下列问题:
(1)写出下列物质的结构简式:
A、C。
(2)写出下列反应的化学方程式:(注明反应条件及反应类型)。
A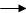 B:反应类型。
B:反应类型。
B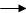 D:反应类型。
D:反应类型。
E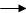 H:反应类型。
H:反应类型。
G+E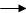 I:反应类型。
I:反应类型。
(3)已知H的一种同分异构体K能发生银镜反应,写出K与银氨溶液反应的化学方程式:
。
(1)已知某有机物的结构简式为: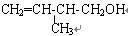 ,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
(2)已知某高分子化合物的结构简式为: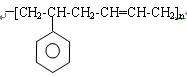
写出合成该高分子化合物的单体(用结构简式表示)
下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
⑧ |
⑩ |
|||||
| 3 |
① |
③ |
⑤ |
⑦ |
⑨ |
|||
| 4 |
② |
④ |
11 |
 (1)这11种元素中,化学性质最不活泼的元素是(用元素符号或化学式表示,下同),得电子能力最强的原子对应的单质是,失电子能力最强的原子对应的单质与水反应的化学方程式是。常温下为液态的非金属单质是。
(1)这11种元素中,化学性质最不活泼的元素是(用元素符号或化学式表示,下同),得电子能力最强的原子对应的单质是,失电子能力最强的原子对应的单质与水反应的化学方程式是。常温下为液态的非金属单质是。
(2)元素④的离子结构示意图为。
(3)⑥、⑦、⑧气态氢化物的化学式分别为、、,其中以最稳定。⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:、;其中以酸性最强。
(4)③和⑨两种元素形成的化合物属于(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程。
(5)写出③的单质置换出⑥的单质的化学方程式。
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示: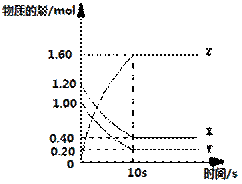
(1)该反应的化学方程式为:。
(2)反应开始至10s末,X的平均反应速率为:。
(3)若在第10s时分离出部分Y,则容器中X的物质的量会________(填“增大”、“减小”或“不变”)。
已知aAn+、bB(n+1)+、cCn-、dD(n+1)─具有相同的核外电子排布,则a、b、c、d由大到小的顺序是____________,这四种离子的半径由大到小的顺序是。