请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____ 硝酸(填“浓”或“稀”),相应的离子方程式是 。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)= 。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO21mol,此时v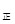 v
v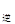 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____ (填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____ (填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO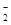 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H2的88倍,C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色。

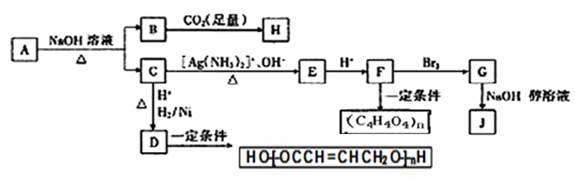
(1)A分子中含有的官能团有 。
C→E的反应方程式为 。
(2)写出由G生成J的反应方程式为 。
(3)由D生成 HO-[-OC CH = CHCH2 O-]-nH的反应类型为 。由F到G的反应类型为 。
(4)A的同分异构体甚多,满足下列条件的A的有同分异构体有 种(不考虑立体异构),
①含苯环,②含羧基,③含醛基,④含碳碳双键。
其中核磁共振氢谱峰面积比是1:2:2:2:1的的是 。
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵晶体:
ⅰ.酸性条件下,铈在水溶液中有 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是 。
| A.NaClO | B.H2O2 | C.KMnO4 | D.浓硫酸 |
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号);反应①的离子方程式为 。
(4)用滴定法测定制得的Ce(OH)4产品纯度:
滴定时所用定量仪器的最小刻度为 ;所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I. N2(g)+3H2(g) 2NH3(g)△H=-90.0kJ/mol
2NH3(g)△H=-90.0kJ/mol
II. 2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.0kJ/mol
4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 。
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如图(图中所示数据均为初始物理量)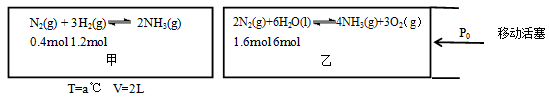
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解)
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= ;
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。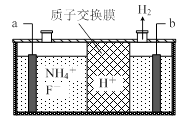
a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知N2O4(g) 2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
①25℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
②0℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
a.加深 b.变浅 c. 不变 d.无法判断
(5)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s) Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)="1.0" mol·L-1,应调节溶液的pH= (已知lg2=0.3)
Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)="1.0" mol·L-1,应调节溶液的pH= (已知lg2=0.3)
I.氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和氢氧化钠固体,产生氨气的原因是: ;氨气的检验方法是: 。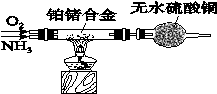
通过如图装置(尾气处理装置已略去)验证了氨有还原性,硬质玻璃管中氨发生催化氧化反应的化学方程式为_________________________。
(3)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2+2O2=2NO2 N2H4+O2=N2 +2H2O
发射卫星用气体肼为原料,以NO2气体为氧化剂。若1 g气体肼与NO2气体反应生成氮气和水蒸气放出a kJ热量,写出反应的热化学方程式______________________。反应中生成N2质量为42g,则转移电子的物质的量为________________。
II.已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol
③H2O(g)=H2O(l)△H=-44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
I.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出M的元素符号: ____________,Z的原子结构示意图: ____________。M与X两元素可形成两种液态化合物,其化学式分别为 。
(2)请写出N元素在周期表中的位置 ;与N同族的短周期元素L,其最高价氧化物的电子式为 。
(3)Y与Z相比,非金属性较强的元素是___,(填元素符号)可以证明该结论的实验事实是 。
II.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A为红棕色固体,C、D、E是中学常见的三种化合物。分析转化关系回答问题。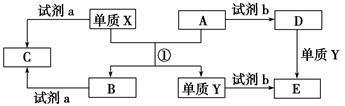
(1)请写出反应①的化学方程式:________________________________。
(2)由D到E的离子方程式_________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式 。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为______________。