T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(Ⅰ)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
| A.图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol·L-1X、0.4 mol·L-1 Y、0.2mol/LZ保持其他 |
条件不变,达到平衡时z的浓度为0.4 mol·L-1
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A.H2O(g)===H2(g)+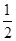 O2(g) ΔH=-485 kJ·mol-1 O2(g) ΔH=-485 kJ·mol-1 |
B.H2O(g)===H2(g)+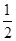 O2(g) ΔH=+485 kJ·mol-1 O2(g) ΔH=+485 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1 |
| D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1 |
COCl2(g)  CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是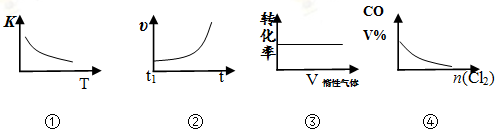
| A.①表示随温度升高,平衡常数的变化 |
| B.②表示加入催化剂,反应速率随时间的变化 |
| C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 |
| D.④表示CO的体积分数随充入Cl2量的变化 |
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g) CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是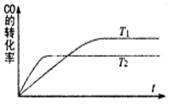
| A.T1>T2 |
| B.该反应的△H >0 |
| C.T1时的平衡常数K1> T2时的平衡常数K2 |
| D.T1时的平衡常数K1< T2时的平衡常数K2 |
可逆反应:A(g)  B(g),其反应过程中能量变化如下图所示,下列说法错误的是
B(g),其反应过程中能量变化如下图所示,下列说法错误的是
(以Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)
| A.该反应的 ΔH = Ea(正) - Ea(逆) |
| B.该反应的Ea(正) = E3 - E2 |
| C.只要温度升高,该可逆反应就会向逆反应方向进行 |
D.可逆反应B(g)  A(g)的ΔH = E2- E1 A(g)的ΔH = E2- E1 |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.c1∶c2=3∶1 |
| B.X、Y的转化率不相等 |
| C.平衡时,Y和Z的生成速率之比为2∶3 |
| D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1 |