某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。 向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐 加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX中所含质子的物质的量是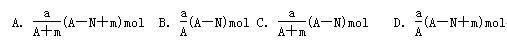
已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述
正确的是
| A.原子半径 A>B>D>C | B.离子半径 C2—>D—>B+>A2+ |
| C.原子序数 d>c>b>a | D.单质的还原性 A>B>D>C |
下列排列顺序正确的是 ①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
| A.②④ | B.①③ | C.①④ | D.②③ |
已知某元素原子的各级电离能数值如下:
I1="736" kJ·mol-1,I2="1450" kJ·mol-1,I3="7740" kJ·mol-1,I4="10500" kJ·mol-1,
I5="13" 600 kJ·mol-1,则该原子形成离子的化合价为
| A.+1 | B.+2 | C.+3 | D.+4 |
国家核事故应急协调委员会2011年4月4日权威发布:我国内地31个省、自治区、直辖市部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素131I。下列有关说法正确的是
| A.131I与127I互为同素异形体。 | B.131I比127I多4个质子 |
| C.131I与127I是同一核素 | D.131I与127I互为同位素 |