硼元素B在化学中有很重要的地位。硼的化合物在农业、医药、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式_________________。从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为___________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是_____________________________。
(3)在BF3分子中中心原子的杂化轨道类型是__________,SiF4微粒的空间构型是__________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4一后者却是生成SiF62—:______________________________________________。
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。下图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为_______。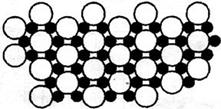
右图是一个化学过程的示意图。已知甲池的总反应式为:

(1)请回答下列电极的名称:通入CH3OH的电极名称是,
B(石墨)电极的名称是。
(2)写出电极反应式: 通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(3)乙池中反应的化学方程式为。
下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题: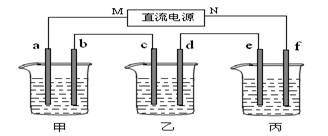
(1)电源的N端为极;
(2)电极b上发生的电极反应为;
(3)电极c上生成的气体在标准状态下的体积:;
(4)甲溶液的氢氧根离子浓度为(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为,e电极的材料是:,f电极的电极反应式为。
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是;
此反应离子方程式为;
⑵ 在溶液B中加入CuO的作用是;
⑶ 操作a的目的是;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是。
25℃、1.01×105Pa时,氢硫酸饱和溶液的浓度为0.1mol·L-1,氢硫酸溶液呈酸性,用方程式表示主要原因。向溶液中加入少量Na2S晶体,振荡后溶液的pH将(填“增大”、“减小”或“不变”)。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、分液法 B、加热分解 C、结晶法 D、分液法 E、蒸馏法 F、过滤法
(1)分离饱和食盐水和沙子的混合物
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)分离水和汽油的混合物
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶