反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
下列铵盐①NH4F②NH4Cl③NH4Br④NH4I,其热稳定性由强到弱的顺序为( )
| A.④>③>②>① | B.①>②>③>④ |
| C.①>④>③>② | D.无法确定 |
在标准状况下,在三个干燥的烧瓶内分别装入有干燥纯净的NH3、含一半空气的氯化氢气体、NO2和O2的混合气体〔V(NO2)∶V(O2)=4∶17〕。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
| A.2∶1∶2 | B.5∶5∶4 |
| C.1∶1∶1 | D.无法确定 |
用加热方法可分离的一组物质是()
| A.氯化铵和消石灰 | B.碳铵和过氧化钠 |
| C.碘和食盐 | D.硝酸铵和硫酸钠 |
有关氨的说法不正确的是()
| A.NH3是4核10电子极性分子,三角锥形,具有还原性 |
| B.NH3极易溶于水,可做喷泉实验,氨气易液化,液氨可用作制冷剂 |
| C.氨气是非电解质,氨水是电解质 |
| D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟 |
用下图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是()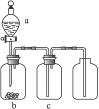
| 气体 |
a |
b |
c |
|
| A |
CO2 |
稀硫酸 |
CaCO3 |
粉末浓硫酸 |
| B |
SO2 |
浓硫酸 |
Cu |
KMnO4酸性溶液 |
| C |
NH3 |
浓氯水 |
生石灰 |
浓硫酸 |
| D |
NO2 |
浓硝酸 |
铜片 |
NaOH溶液 |