设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,13.8 gNO2气体溶于水,转移电子数为0.2 NA |
| B.标准状况下,22.4 L甲醇含有的原子数为5 NA |
| C.标准状况下,224 mL CO2溶于足量NaOH溶液中得到的阴离子数为0.01 NA |
| D.常温常压下,3.4 gNH3中含有的共用电子对数目为0.3NA |
能用图1-4所示装置进行喷泉实验的一组气体是()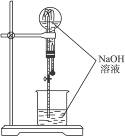
图1-4
| A.HCl和CO2 | B.NH3和CH4 | C.SO2和CO | D.NO2和NO |
氨气可以做喷泉实验,这是利用氨气()
| A.很易液化 | B.比空气轻 |
| C.极易溶于水 | D.能跟水起反应 |
某硫酸铵样品,测得其中氮元素的质量分数为20%,其样品中可能含有的另一种氮肥是()
| A.CO(NH2)2(尿素) | B.NH4HCO3 |
| C.NH4NO3 | D.NH4Cl |
由反应8NH3+3Cl2====N2+6NH4Cl可知,30 mL Cl2能氧化相同条件下的NH3的体积为()
| A.80 ml | B.40 mL | C.20 mL | D.10 mL |
相同物质的量浓度,相同体积的(NH4)2HPO4、(NH4)3PO4和NH4H2PO4三种溶液分别滴加相同物质的量浓度的NaOH溶液直至完全反应,则三种溶液耗用NaOH溶液体积之比是()
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.6∶3∶2 |