太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为 ;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为 。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得右图所示的金刚砂(SiC)结构;若在晶体硅所有Si—Si键中插入O原子即得SiO2晶体。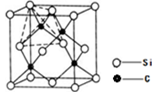
①在SiC中,每个C原子周围最近的C原子数目为 ;
②判断a. SiO2,b.干冰,c.冰3种晶体的熔点从小到大的顺序是 (填序号)。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
||||||||||||||||
试回答下列问题:
(1)请写出:元素o的基态原子电子排布式。
(2)k在空气中燃烧产物的分子构型为,中心原子的杂化形式为,该分子是(填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为(填元素符号)。
(5)所有元素中电负性最大的是(填图中序号所示的元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为。(填化学式)
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为;
(2)写出与H2O分子互为等电子体的微粒(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是;
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
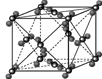
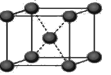
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是
(请用相应的编号字母填写);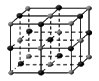

ABCDE
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:。
(1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号)。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
(1)写出该反应的热化学方程式。
(2)关于该反应的下列说法中,正确的是。
A.△H>0,△S>0B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:。
(4)温度降低,平衡常数K(填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=。
(6)下列措施中能使 增大的有。
增大的有。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是;转移电子的物质的量为mol。
(2)反应后,若产生14g N2,则有g NH3被氧化。