化学反应原理在工业生产中具有十分重要的意义。
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式 。还可以由天然气或重油制取氢气:CH4+H2O(g) 高温催化剂CO+3H2;比较以上两种方法转移6mol电子时,C和CH4的质量之比是 。
(2)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下: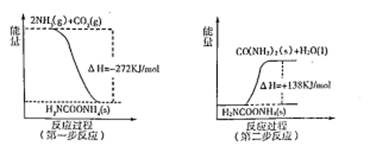
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(3)已知反应Fe(s)+CO2(g)=FeO(s)+CO(g) △H=akJ/mol。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“:”)。在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5min后达到平街时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
(4分)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为________________。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为___________。
2.4克镁与稀盐酸恰好完全反应,计算:
(1)在标准状态下生成H2多少升?
(2)若完全反应后所得溶液的体积为125毫升,则所得溶液的物质的量浓度为多少?
(3)若把镁离子全部转化为氢氧化镁则需要1mol / L的氢氧化钠多少毫升?
与c(H+)·c(OH-)=Kw类似,FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),
Fe2+(aq)+S2-(aq),
c(Fe2+)·c(S2-)=Ksp。常温下Ksp=8.1×10-17。
(1)理论上FeS的溶解度为____________________________________________。
(2)又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为______。
(6分)某同学欲配制250 mL 2 mol·L-1的碳酸钠溶液,并进行有关实验。请回答下列问题:
(1)需称量无水碳酸钠的质量 g。
(2)配制该碳酸钠溶液时使用的仪器除天平(带砝码)、烧杯、玻璃棒外,还必须用到的仪器有 、 等。
(3)取所配制的碳酸钠溶液125 mL,向其加入125 mL 3mol·L-1的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出) ;设反应后溶液的体积为250mL,则反应后溶液中Na+的物质的量浓度为 。
在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,有19.2gCu被氧化,则被还原的HNO3的质量为多少?