硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01× Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
| D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大 |
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO3-,SO32-离子的浓度由大到小的顺序是__________________。
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
有AlCl3和MgCl2的固体混合物,取一定量的该混合物加水溶解配成溶液,实验测知Cl-的物质的量为0.70摩尔,如向该混合溶液中逐滴加入8.00mol/L的氢氧化钠溶液(密度为1.27g/mL),加入氢氧化钠溶液的体积(V)和沉淀的质量(m)有右图所示的关系。
求:(1)原NaOH溶液的质量分数为。
(2)AlCl3和MgCl2的物质的量分别是多少?
(3)另取64.70克该混合物溶于水,要使沉淀质量最大,需要加入8.00mol/L的氢氧化钠溶液多少毫升?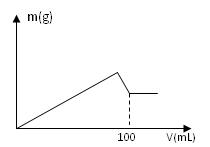
较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学小组均用200 mL 12 mol/L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气。分析实验结果发现:①甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值。②甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:(1)上述实验中理论上最多可制得Ca(ClO)2多少克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因。
氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,用0.100mol/LHCl溶液中和,共消耗盐酸20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中, 在标准状况下放出1.12LH2。求:
在标准状况下放出1.12LH2。求:
(1)产生H2的物质的量为多少?
(2)原混合物中金属钠的质量为多少克?
(3)若反应后溶液的体积为40mL,所得溶液的物质的量浓度为多少?
随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注。下图是最近研发出的天然气利用新途径:首先甲烷在催化剂作用下发生“氧氯化反应”生成一氯甲烷;然后一氯甲烷在400°C的条件下通过分子筛催化转化为低碳烯烃。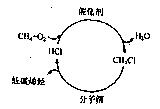
请根据以上信息回答下列问题:
(1)第一轮次反应投料时甲烷和氯化氢的最佳体积比(相同条件)为。
(2)由一氯甲烷生成丙烯的化学方程式为。
(3)按最佳反应投料比,若该途径中的第一步“甲烷氧氯化反应”的转化率为80%,经除水、分离出混合物中的一氯甲烷后,剩余CH4、O2和HCl全部留用并投入第二轮次生产;第二步一氯甲烷反应生成含有乙烯、丙烯、丁烯和氯化氢的混合气体,碳原子的利用率为90%,分离出其中的烯烃气体后,剩余HCl也全部留用并投入第二轮次生产,则:
①标准状况下,1m3甲烷经过一轮反应可得到kg乙烯、丙烯、丁烯的混
合气体。
②为了与第一轮次得到的等量的低碳烯烃,第二轮次反应投料时,需补充的CH4、
O2和HCl的体积比为(相同条件)。(请写出①和②的计算过程)