下表是元素周期表的一部分,请根据表中信息回答下列问题:
| 族 周期 |
ⅠA |
0 |
||||||
| 1 |
1 H 氢 1.008 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
2 He 氦 4.003 |
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 20.18 |
| 3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)氯元素的相对原子质量是
(2)由原子序数为8和13的元素形成的化合物的化学式是
(3)第二、三周期的元素排列从左往右所遵循的规律是
南海油气资源丰富,石油加工可得到石油液化气,假设某石油液化气的主要成分为C4H10,写出其完全燃烧的化学方程式
;小明家欲将石油液气灶改为天然气(主要成分CH4)灶具,他应将空气管口 减小(填“增大”或“减小”);CH4属于有机(填“有机物”或“无机物”)
漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应
Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)漂白粉是一种(填“纯净物”或“混合物”)。
(2)HClO在常温下分解,反应为2 HClO=2HCl+ O2↑。某瓶HClO溶液放置一段时间后,溶液的pH(填“增大”或“减小”或“不变”)。
(3)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式。
自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容。
| 项目 |
标准 |
| 感官指标 |
无异味、异臭等 |
| 化学指标 |
pH6.5-8.5,铜<1.0mg·L-1,铁<0.3mg·L-1,氟化物<1.0mg·L-1,游离氯≥0.3mg·L-1等 |
(1)感官指标表现的是自来水的性质(填“物理”或“化学”);若化学指标中的pH =8时,表明自来水呈(填“酸性”、 “碱性”或“中性”)。
(2)自来水属于(填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是。
(3)实验室用自来水制取蒸馏水的方法是。
A.吸附 B.沉淀 C.过滤 D.蒸馏
(4)长期饮用蒸馏水(填“利于”或“不利于”)人体健康。
请从氢气、氧化钙、氢氧化钙、硫酸四种物质中,选择适当的物质,按要求写出物质的化学式:
(1)一种单质;(2)一种氧化物;
(3)用于改良酸性土壤的一种碱; (4)用于除锈的一种酸。
通过仔细、化学是一门以实验为基础的科学。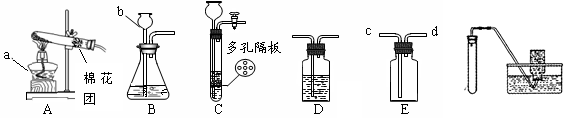
(1)用高锰酸钾固体制氧气,选用的发生装置是(填“A”、“B”或“C”),装入药品前应先,反应的化学方程式是。
(2)实验室用B装置制取二氧化碳时,b中应加入(填写试剂名称)。如用E装置收集CO2,则气体应从端通入(填“c”或“d”)。
(3)用块状固体和液体不加热制取气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是。
(4)小红同学用F装置(夹持装置未画出)制取氧气发现收集的氧气不纯净,小红通过仔细思考发现F装置图中有一明显错误会造成收集气体不纯,请同学指出 。