用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
A.负极的电极反应式为:CO+O2-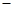 2e-=CO2 2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂: HIn(aq)(红色)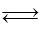 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
已知4NH3(g)+5O2(g) 4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是( )
4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是( )
A.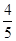 v(NH3)=v(O2) v(NH3)=v(O2) |
B.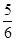 v(O2)=v(H2O) v(O2)=v(H2O) |
C.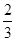 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.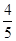 v(O2)=v(NO) v(O2)=v(NO) |
下列说法中正确的是( )
| A.二氧化硫溶于水能导电,故二氧化硫属于电解质 |
| B.硫酸钡难溶于水,故硫酸钡属于弱电解质 |
| C.硫酸是强电解质,故纯硫酸能导电 |
| D.氢离子浓度相同的盐酸和醋酸导电能力相同 |
在相同条件下,取等量H2O2做H2O2分解的对比实验,其中(1)加入MnO2催化,(2)不加MnO2催化。下图是反应放出O2的体积随时间的变化关系示意图,其中正确的是( ) A. B. C. D.
A. B. C. D.
升高温度时,化学反应速率加快,主要原因是( )
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.该化学反应的过程是放热的 |