铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C. > > |
D. < < |
用NaOH与Na2CO3·nH2O的混合物共28 g配制成100 mL溶液,测得该溶液中c(Na+)=4 mol/L。另取相同质量的上述混合物,加入足量的盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,试计算:
(1)原混合物中NaOH的质量分数。
(2)Na2CO3·nH2O中n值。
将质量为m1的NaHCO3固体用酒精灯加热一段时间后,测得剩余固体的质量为m2。
(1)发生反应的NaHCO3质量为多少?
(2)当剩余固体的质量为多少时,可以断定NaHCO3已分解完全?
将镁、铝的混合物0.1 mol 溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示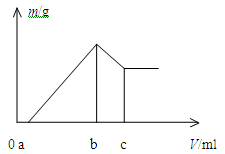
计算:(1)当a =" 160" mL时,金属混合物中n(Mg)=mol,n(Al)=mol,c =mL;
(2)若欲使Mg2+、Al3+刚好完全沉淀,则加入的NaOH的体积V应为多少毫升?
(4分)pH=13的强碱溶液与pH=2的强酸混合,已知所得混合溶液的pH=11,求混合前强碱与强酸溶液的体积比。
现有5.8g有机物完全燃烧,只生成CO2和H2O气其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰质量增加18.6g,相同质量的有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2。
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)有机物的结构式 。
(提示:羟基和双键不能连在同一个碳上)