已知短周期的主族元素X、Y、Z、W、M的原子序数依次增大,X 是常见化肥的主要元素,Y 原子的最外层只有2个电子,Z单质可制成半导体材料,W元素形成的单质为黄色的固体。请回答以下问题:
(1)元素W在周期表的位置为 ;
(2)X与Y形成的化合物的电子式 ;
(3)Z的氧化物晶体类型为 ,12gZ的氧化物中含有的共价键数为 ;
(4)X、W形成的氢化物分别为甲和乙,且甲、乙所含的电子数相等,则甲的结构式为 ;
(5)W和M都是较活泼的非金属元素,用实验事实表明这两种元素的非金属性强弱 (用方程式书写或文字说明)。
物质A经下图所示的过程转化为含氧酸D,D为强酸,请回答下列问题: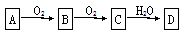
(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A________;C________。
②将C通入水溶液中,反应化学方程式为________________________。
若仅A、B在常温下为气体且为化合物,则回答:
①A的化学式是:A________。
②B生成C的化学方程式为________________________。
③一定条件下碳单质与D反应的方程式为________________________,该反应中D起到的
作用是________________.
(3)若A在常温下为固体单质则回答:
①D的化学式是________;
②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积_______22.4L
(填“大于”“等于”或“小于”),原因为_________________________________。
(12分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下图为相关实验步骤和实验现象: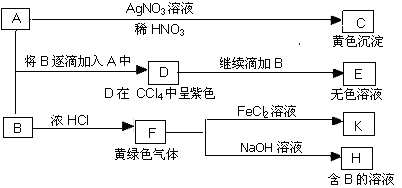
请回答:(1)写出A、B和C的化学式:A,B,C。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:,。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: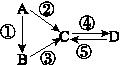
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液。如④反应时通入过量的一种引起温室效应的主要气体,写出该气体的电子式:,A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:_____________________。D的化学式是______。
A—G及X、Y均是中学化学常见物质,其中A是金属氧化物,B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。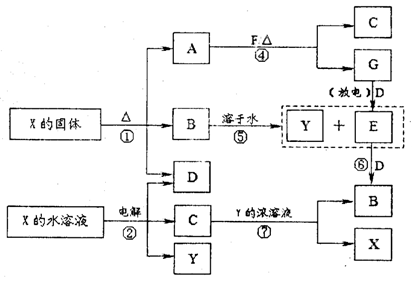
(1)写出反应⑤的离子方程式。
(2)写出反应⑦的离子方程式。
(3)写出电解X溶液的阳极反应式。
(4)写出反应④的化学方程式。
(5)若使F按下列途径完全转化为Y,则参加反应的F与整个过程中消耗D的物质的量之比为。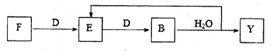
.[化学——选修5:有机化学基础]
已知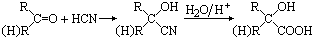 ,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成: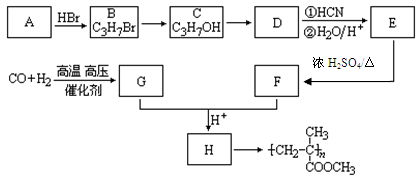
(1)A、E的结构简式分别为:、;
(2)B→C、E→F的反应类型分别为:、;
(3)写出下列转化的化学方程式:
C→D;
G+F→H;
(4)要检验B中的Br元素,可用的操作和现象为。
(5)写出符合下列要求的H的同分异构体①有一个支链②能使溴的四氯化碳溶液褪色③跟NaHCO3反应生成CO2,。(只要求写出2个)