将CO2转化为甲醇的原理为 CO2(g)+3H2(g) 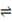 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是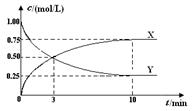
| A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |
相同物质的量的Na2O2和Na2O的比较中,不正确的是
A. 两种物质所含原子个数之比为4∶3 两种物质所含原子个数之比为4∶3 |
| B.两种物质所含离子个数之比为4∶3 |
| C.两种物质与足量的CO2反应,消耗气体的质量比为1∶1 |
| D.两种物质与等质量且足量的水反应得到溶液的质量分数之比为1∶1 |
下列对有关实验事实的解释正确的是
| A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理相同 |
| C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,不能说明原溶液一定含有SO42- |
| D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
足量的两份铝粉分别与等体积的NaOH溶液和稀硫酸反应,同温同压下产生等体积的气体,则NaOH溶液和稀硫酸的物质的量浓度之比为
| A.3:2 | B.2:3 | C.1:3 | D.1:1 |
设NA表示阿伏加德罗常数的值,下列说法错误的是
| A.常温常压下,32gO2和O3的混合气体所含原子数为2NA |
| B.将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA |
| C.标准状况下,11.2LSO2中含有的分子数为0.5NA |
| D.23g钠与足量氧气充分反应,转移的电子数一定是NA |
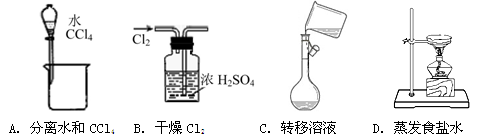
下列能达到实验目的的是