下列离子方程式正确的是
| A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓ |
| B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.向苯酚溶液中滴加Na2CO3溶液: |
| D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-= 3Fe3++NO↑+2H2O |
现代家居装修材料中,普遍存在着甲醛、苯及苯的同系物等有毒物质,如果不注意处理就会对人体产生极大的危害。按照有机物的分类,甲醛属于醛。下列各项对有机物的分类方法与此方法相同的是()
①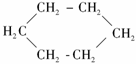 属于环状化合物;②
属于环状化合物;② 属于卤代烃;
属于卤代烃;
③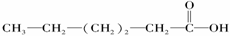 属于链状化合物;④
属于链状化合物;④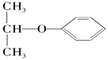 属于醚
属于醚
| A.①② | B.②③ | C.②④ | D.①④ |
下列各有机物的名称肯定错误的是 ( )
| A.3-甲基-2-戊烯 | B.3-甲基-2-丁烯 |
| C.2,2—二甲基丙烷 | D.3-甲基-1-丁烯 |
下列化学名词或化学用语正确的是
| A.三溴笨酚 | B.乙酸的实验式:CH2O |
| C.梭基 | D.氢氧根的电子式: 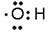 |
下列物质属于有机物的是( )
| A.CO(NH2)2 | B.CaC2 | C.Na2CO3 | D.CO |
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是()
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.不使电池中渗漏的电解液腐蚀其他物品 |
| D.回收其中的石墨电极 |