人体血液里存在如下平衡: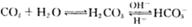 使人体血液pH值保持在7. 35---7. 45之间,否则就会发生酸中毒或碱中毒。其pH值随c(HCO- 3):c(H2CO3)变化关系如下表所示,则下列说法中,正确的是
使人体血液pH值保持在7. 35---7. 45之间,否则就会发生酸中毒或碱中毒。其pH值随c(HCO- 3):c(H2CO3)变化关系如下表所示,则下列说法中,正确的是
| c(HCO3-):c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
| pH |
6.10 |
7.35 |
7.40 |
7.45 |
A.正常人体血液中,HCO3-的水解程度小于电离程度
B.人体发生酸中毒时,可饮用碳酸饮料缓解
C.pH=7.00的血液中,c(H2CO3)=c(HCO- 3)
D.常温下pH=7.40的血液稀释至pH=7.35,[H+]·[OH-]一定不变
在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是
| A.在该温度下平衡常数K=1 | B.平衡常数与反应温度无关 |
| C.CO的转化率为50% | D.其他条件不变改变压强平衡不移动 |
某温度下,反应SO2(g)+ O2(g)
O2(g)  SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g)+O2(g)的平衡常数K2的值为( )
2SO2(g)+O2(g)的平衡常数K2的值为( )
| A.2 500 | B.100 | C.4×10-4 | D.2×10-2 |
aX(g)+bY(g)  cZ(g)+dW(g)在一定容积的密闭容器中反应,5 min时达到平衡,X减少 n mol/L,Y减少
cZ(g)+dW(g)在一定容积的密闭容器中反应,5 min时达到平衡,X减少 n mol/L,Y减少 mol/L,Z增加
mol/L,Z增加 mol/L。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为 ( )
mol/L。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为 ( )
| A.3∶1∶2∶1 | B.1∶3∶2∶2 | C.1∶3∶1∶2 | D.3∶1∶2∶2 |
参照反应Br+H2―→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
| A.正反应为吸热反应 | B.加入催化剂,该化学反应的反应热增大 |
| C.正反应为放热反应 | D.从图中可看出,该反应的反应热与反应途径有关 |

设C+CO2 2CO(正反应吸热),反应速率为v1;N2+3H2
2CO(正反应吸热),反应速率为v1;N2+3H2 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况是( )
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况是( )
| A.同时增大 | B.同时减小 | C.v1增加,v2减小 | D.v1减小,v2增大 |