白云石的主要成分为CaCO3、MgCO3,还含有少量Fe、Si的化合物,实验室以白云石为原料制Mg(OH)2及CaCO3。步骤如下: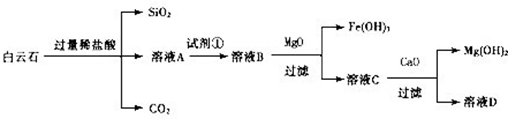
实验过程中需要的数据见下表:
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ |
1.9 |
3.2 |
| Fe2+ |
7.0 |
9.0 |
| Mg2+ |
9.5 |
11.0 |
请回答下列问题:
(1)过滤中所需的玻璃仪器是 。溶液A中含有Ca2+,Mg2+,Fe2+,Fe3+,则试剂①可选择
(填字母)
A.KMnO4 B.Cl2 C.H2O2
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是 ,然后通入CO2。通入CO2气体时请把右边的装置图补充完整(不允许更换溶液,导气管以下连接的仪器自选)。
(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为 。
(4)若将制取的Mg(OH)2:加入到某聚乙烯树脂中,树脂可燃性大大降低,Mg(OH)起阻燃作用的主要原因是 。
把相同物质的量浓度的盐酸、NaOH、NaCl、CH3COOH、NH3·H2O、C2H5OH溶液分别倒入六个烧杯中,接通电源。试回答:
(1)为什么连接C2H5OH的水溶液的灯泡不亮;其余的灯泡均亮了;
(2)为什么连接盐酸、NaOH、NaCl的水溶液的灯泡亮度一致,连接CH3COOH、NH3·H2O的水溶液的灯泡亮度一致且比连接HCl、NaOH、NaCl的水溶液的灯泡要暗。
现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了鉴别四种溶液各是什么,将它们随意编号为A、B、C、D后,按下表进行实验,产生的现象如下表所示。
试根据实验现象回答:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A+B |
没有现象发生 |
| ② |
B+D |
有气体放出 |
| ③ |
C+B |
有沉淀生成 |
| ④ |
A+D |
有沉淀生成 |
(1)推断并写出各物质的化学式:
A、B、C、 D。
(2)写出各序号实验中有关反应的离子方程式,不反应的说明理由。
①
②
③
④
如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
 (1)该实验中,观察到的现象有
(1)该实验中,观察到的现象有
①,
②。
(2)写出该实验中反应的离子方程式
。
[有机化学基础]苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化 合物。已知:
合物。已知:
(1)写出反应类型:④__________________,A中含有官能团的名称。
(2)写出C的结构简式____________________,G的结构简式_____________________。
(3)写出反应B与氢氧化钠反应的化学方程式___________________________________________。
(4)写出反应②的化学方程式______________________________________________。
(5)写出反应⑧的化学方程式_______________________________________________。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是__________。
(a)三氯化铁溶液(b)碳酸氢钠溶液(c)石蕊试液
(7)保持官能团和位置不变,写出B的同分异构体有种
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示)
(2)图1中虚线部分是通过改变化学反应中的条件,请解释原因
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是(“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为(已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)