钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
| A.未知物质X为CO2,属于氧化产物 |
| B.每转移1mol e-时,生成2mol X |
| C.反应中PdCl2作氧化剂,被还原 |
| D.还原性:CO>Pd |
下列离子方程式中不正确的是 ( )
| A.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-=CaCO3↓+H2O |
| B.硫代硫酸钠与稀硫酸反应的离子方程式为S2O32-+2H+=SO42-+S↓+H2O |
C.利用水解原理制备纳米材料TiCl4+(2+n)H2O 4HCl+TiO2·nH2O↓ 4HCl+TiO2·nH2O↓ |
| D.向明矾溶液中滴加Ba(OH)2至SO42-恰好完全沉淀时 |
Al3+ +2SO42-+2Ba2+ +4OH-=AlO2-+2BaSO4↓+2H2O
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA |
| B.1 mol -CH3和1 mol OH- 都含有10 NA个电子 |
| C.标准状况下3.36 L CCl4含碳原子数为0.15NA |
| D.1mol Na完全反应生成Na2O2时失去NA个电子 |
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
下列有机反应的化学方程式正确的是
A.CH3CH2Br+NaOH  CH2=CH2↑+NaBr+H2O CH2=CH2↑+NaBr+H2O |
B.2 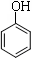 + 3Br2 → 2 + 3Br2 → 2  ↓ ↓ |
C.nCH2=CH-CH3 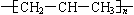 |
D.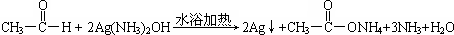 |
短周期主族元素A、B、C、D,原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C<D
B.非金属性:A>C
C.最高价氧化物对应水化物的酸性:D<C
D.单质B常温下能溶于浓硝酸