水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,______________________和是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式______________________________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行____________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______________中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是利用电渗析法由海水获得淡水的原理图。已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。
①阳离子交换膜是指_______________(填“A”或“B”);
②写出通电后阳极区的电极反应式____________。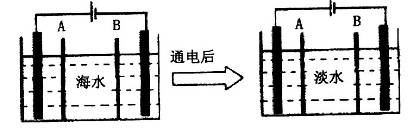
下列物质转化在给定条件下能实现的是
A.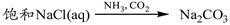 |
B.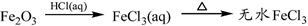 |
C.Al2O3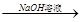 NaAlO2溶液 NaAlO2溶液 Al(OH)3 Al(OH)3 |
D. |
下列装置或操作能达到实验目的的是
① ② ③ ④
| A.装置①可用于证明SO2与NaOH溶液发生了反应 |
| B.若装置②中X为CCl4,可用于吸收氨气或氯化氢 |
| C.装置③可用于实验室从食盐水中提取氯化钠 |
| D.装置④可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯 |
下列溶液中的离子一定能大量共存的是
| A.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B.室温下水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- |
| C.使苯酚显紫色的溶液:NH4+、Na+、C1-、SCN- |
| D.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3- |
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
| A.Y的最高价氧化物对应水化物的酸性比W的强 |
| B.W的气态氢化物比X的稳定 |
| C.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.WX2与ZY2中的化学键类型相同 |
下列有关物质的性质和该性质的应用均正确的是
| A.炭具有强还原性,高温下能将二氧化硅还原为硅 |
| B.Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg |
| C.光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷 |
| D.二氧化锰具有强氧化性,能将双氧水氧化为氧气 |