25℃时,在20 mL 0.1 mol·L-1盐酸中逐滴加入0.2 mol·L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是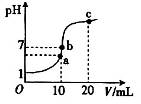
| A.在b点,盐酸与氨水恰好完全中和 |
| B.在b点:c(H+)=c(OH-),c(NH4+)=c(Cl-) |
| C.在a点:c(Cl-)> c(NH4+)> c(H+)> c(OH-) |
| D.在c点:c(NH4+)+ c(NH3·H2O)="2" c(Cl-) |
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养滋补剂,关于维生素P的叙述错误的是:()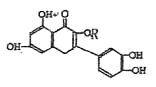
| A.可以和溴水反应 |
| B.跟FeCl3反应,使溶液呈紫色 |
| C.分子中有三个苯环 |
| D.1mol维生素P可以和4molNaOH反应 |
下列卤代烃在KOH醇溶液中加热不反应的是:()
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl④CHCl2-CHBr2⑤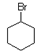 ⑥CH2Cl2
⑥CH2Cl2
| A.①③⑥ | B.②③⑤ | C.②④ | D.①②⑤⑥ |
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示。则下列对混合烃的判断正确的是:()
①一定有C2H4②一定有CH4③一定有C3H8
④一定没有C2H6⑤可能有C2H2⑥可能有C2H2
| A.②⑤⑥ | B.②④ | C.②④⑥ | D.②③ |
下列分子中的所有原子一定处于同一平面的是:()
| A.CH3CH2CH=CH2 | B.CH2=CH-CH=CH2 |
| C.C6H5-C≡CH | D.CH3CH=CH2 |
下列烷烃发生一氯取代后,(不考虑立体异构)能得到二种异构体的是:( )
| A.CH3-CH(CH3)-CH(CH3)-CH3 | B.CH3-C(CH3)2-CH2-CH3 |
| C.(CH3CH2)3C-CH3 | D.(CH3)3C-C(CH3)3 |