下列说法正确的是
| A.第三周期元素的简单离子半径从左到右逐渐减小 |
| B.ⅦA族元素从上到下其氢化物的稳定性越来越强 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.离子化合物中可能含有共价键,共价化合物中不可能含有离子键 |
下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C ΔH<0从熵变角度看,可以自发进行 2MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
下列溶液中微粒的物质的量浓度关系一定正确的是()
| A.0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后,溶液显酸性: c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-) |
| C.0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有: |
c(HCN)+2c(H+)=2c(OH-)+c(CN-)
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )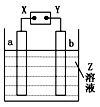
|   |
a极板 |
b极板 |
X电极 |
Z |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
 
当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是()
| A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 |
| B.原电池的正极反应式为:O2十2H2O十4e-=4OH— |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是()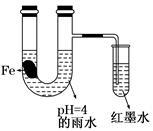
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH- |
| D.U型管中溶液pH逐渐减小 |