(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量的BaCl2溶液后,得到14.51g的白色沉淀,用过量的稀HNO3处理后,沉淀量减少到4.66g,并有气体放出。试求:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度?
(2)产生的气体在标准状况下的体积?
两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则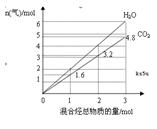
(1)混合烃中n(C):n(H)=
(2)混合烃中一定有
(3)若相对分子质量A<B,试推断混合气体中A和B所有可能的组合及其物质的量之比,并将结果填入下表WWW.K**S*858$$U.COM
(有几组填几组,不一定填满)
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的物质的量比 |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |
|||
| ⑤ |
(1)有两种气态烷烃的混合物,在标准状况下密度为1.16g·L-1,则下列关于此混合物组成中一定含有的烃是的化学式是。该烃和氯气在光照下反应生成的有机物共有种,其中(填写化学式)在常温下呈气态。
(2)燃烧法是测定有机化合物分子式的一种重要方法。完全燃烧0.1mol某烃后,将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0g,再将剩余气体通过澄清石灰水,生成沉淀40g。据此求烃的分子式,并写出该烃可能的结构简式。
在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g)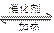 2SO3(g)
2SO3(g)
 2min末测得容器中有7.2mol SO2。
2min末测得容器中有7.2mol SO2。 试回答:
试回答: (1)反应后18O存在哪些物质中 ;
(1)反应后18O存在哪些物质中 ; (2)2min末SO3的浓度;
(2)2min末SO3的浓度; (3)用O2的浓度变化表示该时间段内的化学反应速率。
(3)用O2的浓度变化表示该时间段内的化学反应速率。
把2.5molA和2.5molB混合盛入容积为2L的密闭容器里,发生如下反应:
3A(g) +B(g) x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
速率为0.2mol·L-1·s-1 , 同时生成1molD,试计算:
(1)达到平衡状态时B的转化率?
(2)计算x的值?
(3)达到平衡状态时容器内气体的物质的量是多少?