塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。
合成反应原理为:
实验步骤如下:
步骤1 在三口烧瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器(反应装置如图)。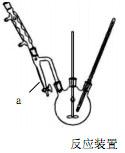
步骤2 缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3 等酯化到一定程度时,升温至150℃
步骤4 冷却,倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5 减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)搅拌器的作用 。
(2)图中仪器a名称及作用是 ;步骤3中确定有大量酯生成的依据是 。
(3)用饱和食盐水代替水洗涤的好处是 。
(4)碳酸钠溶液洗涤的目的是 。
(5)用减压蒸馏的目的是 。
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略)。
(1)按图连接好装置,检查装置的气密性后添加药品:向A装置的分液漏斗中加入浓盐酸,在圆底烧瓶中加入固体KMnO4;向B装置中加入10 mL FeCl2溶液,棉花浸润________溶液;在C装置的分液漏斗中加入70%的硫酸,向圆底烧瓶中加入固体Na2SO3。
(2)打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2。通入一段时间N2的目的是__________________。
(3)关闭K1,K3,K4,打开活塞a 和K2,逐滴加入浓盐酸,A装置中发生反应的方程式为___________。
(4)当B中溶液变为棕黄色时,停止滴加浓盐酸,夹紧K2,打开活塞b,使约2 mL的溶液流入D试管中,分别取1 mL溶液滴入_______(填试剂名称)和铁氰化钾溶液可以证明其中含有Fe3+和Fe2+。此时B中发生反应的离子方程式为____________。
(5)打开K3和活塞c,逐滴加入70%的硫酸,当B中溶液颜色逐渐变为_____色,停止滴加70%的硫酸,夹紧K3,打开活塞b,使约2 mL的溶液流入D试管中,并检验其中的离子。此时B中发生反应的离子方程式为______________。
(6)结合实验现象判断Fe3+、Cl2、SO2氧化性由强到弱的顺序为___________。
如图是制取溴苯的装置,试回答:
(1)装置A中发生有机反应的化学方程式是_ _。
(2)装置C中的现象是____。
(3)如果没有B装置,将A、C直接相连,你认为是否妥当?(填是或否)。
(4)实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:
①蒸镏②水洗③用于燥剂干燥④10%NaOH溶液洗⑤水洗正确的操作顺序是()
A.①②③④⑤ B.④②③①⑤ C.②④⑤③① D.②④①⑤③
(13分)某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。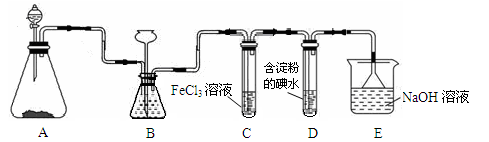
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释。
(2)下列实验方案适用于在装置A中制取所需SO2的是。
a.Na2SO3固体与浓硝酸 b.Na2SO3固体与浓硫酸
c.CaSO3固体与稀硫酸 d.碳与热的浓硫酸
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)往FeCl3溶液中通入足量SO2,反应的离子方程式为。
(5)能表明SO2的还原性强于I-的反应现象为__________________。
(6)装置E的作用为________________。
(7)在上述装置中通入过量的SO2,为了验证C中SO2与Fe3+发生了氧化还原反应,取C中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是,理由是。
从有机反应R—H+Cl2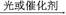 R—Cl+HCl制取副产品盐酸的设想已成为现实。请根据所给模拟装置图回答下列问题:
R—Cl+HCl制取副产品盐酸的设想已成为现实。请根据所给模拟装置图回答下列问题: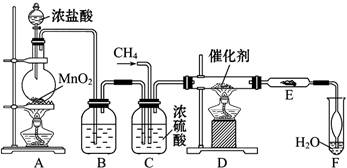
(1)写出实验室制Cl2的离子方程式____________________________________
(2)装置B中盛放的溶液是___________________,作用是____________________。
(3)装置C有三种功能:①_______________;②_______________;③观察气泡的产生情况,便于控制两种气体的配比。
(4)玻璃管E中放在石棉碎块上的碘化钾的作用是:______________。导管末端“肚形”装置的作用是_____________________。
(5)从F中分离出盐酸的最佳方法是_________。该套实验装置还存在的缺陷是。
(共8分)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)(每空1分)用水浴加热而不直接用酒精灯加热的原因是;试管口安装一长导管的作用是。
(2)(每空1分)鉴定生成物中乙醇的结构,可用的波谱是,。
(3)(每空2分)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是,检验的方法是(需说明所用的试剂、简单的实验操作及预测产生的实验现象)。