I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是( )
I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是( )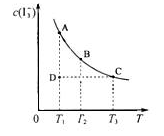
A.反应I2(aq)+I-(aq) I3-(aq)的△H<0 I3-(aq)的△H<0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.若反应进行到状态D时,一定有v正<v逆 |
| D.状态A与状态B相比,状态B的c(I2)大 |
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体说法错误的是
| A.该晶体属于原子晶体,其化学键比金刚石更牢固 |
| B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 |
下列物质的熔、沸点高低顺序正确的是
| A.金刚石>晶体硅>二氧化硅>碳化硅 | B.CI4>CBr4>CCl4>CF4 |
| C.MgO>H2O>N2>O2 | D.金刚石>生铁>钠>纯铁 |
下列微粒的个数比不是1:1的是
下列叙述正确的是
由下列各组的三种元素构成的化合物既有离子晶体,又有分子晶体的是