资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
气体成分为______ |
| 实验Ⅲ |
取实验I中的白色不溶物,洗涤,加入足量 |
|
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验I中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
溶液中存在 ④ 离子 |
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示:
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式 。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因_________。
(8分)(1) 某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有。
②需用托盘天平称取NaOH的质量为g。
(2)从海带中提取碘的流程如下图: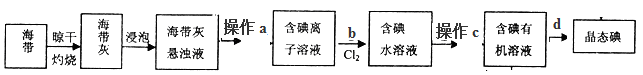
①指出提取碘的过程中实验操作、操作的名称:a__________、c__________
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
。(注:下图试管中深色区为紫红色溶液)
(6分)A、B、C、D四种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+和阴离子OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。通过实验,得出如下结论:
①A和D的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②铜粉能溶解在B的溶液中;
③往C的溶液中加入过量的D溶液,最终没有沉淀。
根据以上实验事实,回答下列问题:
(1) 试写出A和B的化学式:A,B___________。
(2) 试写出实验③中反应的离子方程式。
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
(l)写出装置A中所发生的化学反应
(2)装置B中盛放试剂是
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产
生(填写反应现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式
(4)已知Cu2O是一种红色固体物质, 在高温条件下可由CuO分解得到:4CuO=2Cu2O+O2↑,生成的Cu2O 也能被NH3还原。当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是(用化学式表示)
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 |
预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 |
|
| 用另一干净试管取少量沉淀样品,加入 ______ |
__________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
下图为制取乙酸乙酯的实验装置图。回答下列问题: 
揭示实验原理
乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。