一种重要的药物中间体E的结构简式为: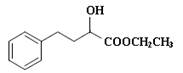 ,合成E和高分子树脂N的路线如下图所示:
,合成E和高分子树脂N的路线如下图所示: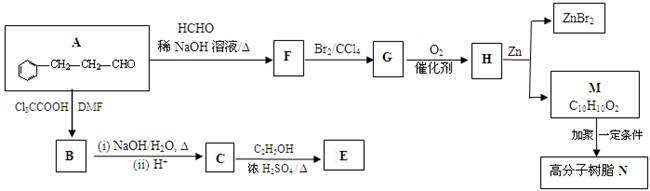
已知:
①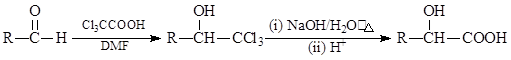
②
请回答下列问题:
(1)合成高分子树脂N
① A中含氧官能团的名称为_____________。
② 由A可制得F,F的结构简式为___________________;F→G的反应类型为__________。
③ G有多种同分异构体,其中一种异构体X的结构简式为: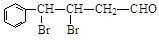 ,下列有关X的说法正确的是___________(填标号)。
,下列有关X的说法正确的是___________(填标号)。
a.能与银氨溶液发生反应
b.能与氢气在一定条件下发生加成反应
c.在碱性条件下发生水解反应,1 mol X消耗2 mol NaOH
d.加热条件下,与NaOH醇溶液反应,只生成一种有机物
④ 写出M→N反应的化学方程式_______。
⑤ 已知碳碳双键能被O2氧化,则上述流程中“F→G”和 “H→M”两步的作用是__________。
(2)合成有机物E
① 写出C→E反应的化学方程式______________________。
② 实验室由C合成E的过程中,可使用如图所示的装置提高反应物的转化率。油水分离器可以随时将水分离除去。请你运用化学平衡原理分析使用油水分离器可提高反应物转化率的原因_________。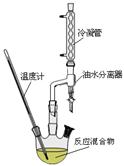
(Ⅰ)某化学兴趣小组的同学得上用下 图所示实验装置进行实验(图中a、b、c表示止水夹)。
图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接:→→(填字母编号)。
②选择所需的试剂:(填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下: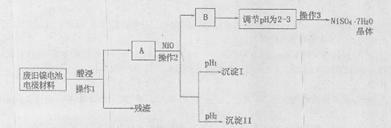
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n |
Ksp |
pH |
|
| 开始沉淀 |
沉淀完全 |
||
| Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
| Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
| Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是沉淀II是(填化学式),pH1pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为。
(3)“调节pH为2-3”的目的是;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是。
A、B、C 、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是,能抑制水 电离的是(各写一种化学式);
电离的是(各写一种化学式);
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为极,其电极反应式为;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为、。
(I)某氮肥厂氨氮废水中的氮元素多以NH 4 +和NH 3·H 2O的形式存在。在微生物作用下,NH 4 +经过两步反应被氧化成NO 3 -,两步反应的能量变化示意图如下: 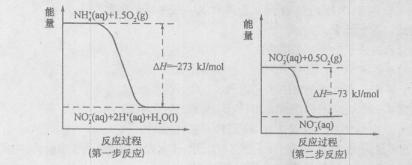
(1)1molNH 4 +(aq)全部氧化成NO 3 -(aq)的热化学方程式是  。
。
(2)在一定条件下,向废水中加入CH 3OH,将HNO 3还原成N 2,若该反应消耗32gCH 3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
(Ⅱ)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO 2和N 2,化学方程式如下:
2NO+2CO  2CO 2+N 2△H
2CO 2+N 2△H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)(×10 -4mol·L -1) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| C(CO)(×10 -3mol·L -1) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写">"、"<"、"=")
(2)前2s内的平均反应速率v(N 2)= ;
(3)在该温度下,反应的平衡常数K= (只写出计算结果);
(4)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,部分实验条件如下表:
| 实验编号 |
T/℃ |
NO初始浓度/mol·L -1 |
CO初始浓度/mol·L -1 |
催化剂的比表面积/m 2·g -1 |
| I |
28  0 0 |
1.20×10 -3 |
5.80×10 -3 |
82 |
| II |
280 |
1.20×10 -3 |
5.80×10 -3 |
124 |
| III |
350 |
1.20×10 -3 |
5.80×10 -3 |
124 |
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号; 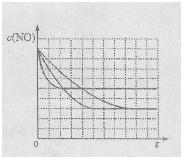
(5)有人认为:催化剂比表面积增大,会提高NO和CO的反应效率,从而使污染物NO和CO的转化率提高。请用化学基本理论对此观点进行评价: 。
(9分) 已知>C=C<可被酸性高锰酸钾溶液氧化成二元醇,如:
现以甲基丙烯为原料合成有机玻璃和环状化合物E(C8H12O4):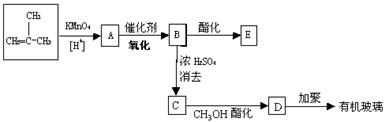
(1) 试写出下列的结构简式: B ______________ C _____________ E _______________
B ______________ C _____________ E _______________
(2) 反应方程式:
B → E _____________________________________________;
B → C _____________________________________________;
C → D _____________________________________________。
(7分)已知(1)丙烯与水进行加成反应,其可能的产物有两种:(2)下图中E为开链的酯类化合物,其分子式为C6H12O2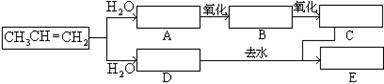
(1)请依据上述条件和图中转化关系,在方框中填入合适的化合物的结构简式。
(2)B和银氨溶液反应生成C的化学方程式。