现有常温下的四份溶液:① 0.01mol/LCH3COOH;② 0.01mol/LHCl;③ pH=12的氨水;④ pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,②③④中水的电离程度一样大 |
| B.将②③混合,若pH=7,则消耗溶液的体积:②<③ |
| C.将①、④混合,若有c(CH3COO¯)>c(H+),则混合液一定呈碱性 |
| D.将①、④等体积混合,所得溶液中一定有:c(OH¯)=c(H+) + c(CH3COOH) |
β-月桂烯的结构如图所示,一分子该物质与溴发生加成反应,得到的产物(只考虑位置异构)理论上最多有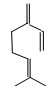
| A.6种 | B.7种 | C.8种 | D.9种 |
化学方程式是一种重要的化学用语。所写的化学方程式不能用来正确解释化学过程或事实的是
A.熔融烧碱时不能使用石英坩埚:SiO2 + 2NaOH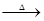 Na2SiO3 + H2O Na2SiO3 + H2O |
| B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2: 2I- +3H2O2 + 2H+ → I2 + O2↑+ 4H2O |
| C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层: 3Fe + 4H2O(g) 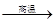 Fe3O4 + 4H2 Fe3O4 + 4H2 |
| D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气: |
ClO-+Cl-+2H+→ Cl2↑+H2O
25℃时,Kw =1.0×10-14;100℃时,Kw =5.4×10-13。对有关溶液pH说法正确的是
| A.100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7 |
| B.100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH="7" |
| D.25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质的物质的量/mol[] |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是
A.反应的平衡常数:③>①>② B.达到平衡时氨气的体积分数:①>③
C.放出的热量(kJ):a<b<92.4 D.反应得到1mol NH3(l),放出热量46.2kJ
依据有关化学原理推断正确的是
| A.常温常压下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B |
| B.晶体A易溶于CCl4,则A一定是分子晶体 |
| C.在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属 |
| D.能量越低越稳定,故自然界的物质都以能量最低的形态存在 |