某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。
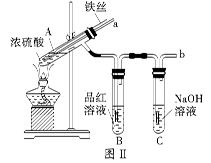
请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
| 步骤 |
所选试剂 |
现象及结论 |
| 1 |
|
|
| 2 |
|
|
| 3 |
|
|
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: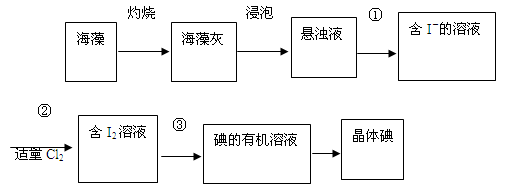
(1)实验操作③的名称是__________,所用主要仪器名称为__________。
(2)提取碘的过程中,可供选择的有机试剂是__________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号)_____溶液,反应的离子方程式为。
A.KIO3B.HClOC.KID.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。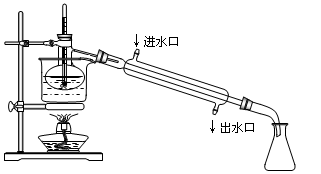
①_________________________,
②_________________________,
③_________________________,
④_________________________。
(5)实验中使用水浴的原因是,最后晶体碘聚集在__________(填仪器名称)中。
某化学兴趣小组为了测定铁碳合金(铁和碳两种单质的混合物)中铁的质量分数,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后______________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为_________________(写表达式)。
(3)装置C的作用______________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是。
2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
Ⅰ.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,请选择装置并按气流方向连接各仪器接口(填装置接口顺序),若要制取、收集干燥的CO2,则需选用上述仪器装置中的(填装置序号)。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是。试写出制纳米级碳酸钙的离子方程式。
Ⅱ.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备TiO2的常见方法:将TiCl4水解产物加热脱水生成TiO2。已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液常温下的pH=2,则此时溶液中:c (Ti4+)=。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要右图中的_______(填字母代号)。
(5)滴定终点的现象是。
(6)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则试样中TiO2质量分数表达式为。
Ⅲ.(7)纳米材料具有很多特殊的优良性能,其颗粒大小一般在1~100 nm之间。试设计简单的实验方案,判断Ⅰ、Ⅱ实验中所得样品颗粒是否为纳米级。
(14分)某学生设计了一套验证物质化学性质的实验装置(如图):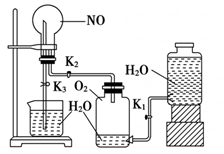
请观察该装置图,完成下列问题:
(1)该实验的目的是。
(2)该实验的涉及的化学方程式有。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)_________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为;③关闭,(填写K1或K2或K3)打开,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
乙二酸( HOOC—COOH)俗称草酸,易溶于水,,电离常数K1=5.4×10-2,K2=5.4×10-5,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸浓溶液,观察到有大量气泡产生,写出该反应的离子方程式:。(碳酸:K1=4.4×10-7)
(2)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ组装好装置,加热3—5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面下的原因是。写出乙二酸与少量乙醇反应的化学反应方程式。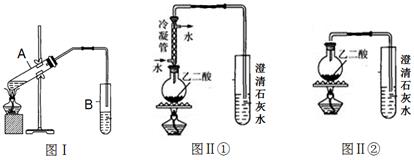
(3)已知草酸分解的化学方程式为:H2C2O4 H2O+CO2↑+CO↑
H2O+CO2↑+CO↑
利用图Ⅱ①和图Ⅱ②加热草酸晶体(夹持仪器忽略),以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清;
图Ⅱ②:试管里澄清石灰水只变浑浊。
能验证草酸受热分解的装置是(填图Ⅱ中的编号“①”或“②”)。
(4)图Ⅱ①中冷凝管的作用是:。