25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
只用一种试剂就能将苯、己烯、四氯化碳和碘化钾溶液区分开,该试剂可以是( )
| A.酸性高锰酸钾溶液 | B.溴化钠溶液 |
| C.溴水 | D.硝酸银溶液 |
苯乙烯是一种重要的有机化工原料,其结构简式为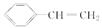 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
| A.易溶于水,不易溶于有机溶剂 |
| B.在空气中燃烧产生黑烟 |
| C.它能使溴的四氯化碳溶液退色,也能使酸性高锰酸钾溶液退色 |
| D.能发生加成反应,在一定条件下可与其4倍物质的量的氢气加成 |
下列关于苯与乙烯的比较中正确的是( )
| A.都能与酸性KMnO4溶液反应 |
| B.等物质的量燃烧时苯消耗氧气多 |
| C.都能与溴水发生加成反应 |
| D.苯分子内所有原子共平面,分子内一个氢原子被甲基取代后,所有原子依旧共平面 |
下列有关变化是由加成反应引起的是( )
| A.点燃苯,产生明亮而带有浓烟的火焰 |
| B.苯与浓硫酸和浓硝酸混合液加热制得硝基苯 |
| C.在镍作催化剂的条件下,苯与H2反应生成环己烷 |
| D.苯中加溴水振荡,溴水层退色 |
2010年5月14日22时,贵新高等级公路贵州龙里县境内发生一起粗苯槽罐车追尾事故,造成30吨苯泄漏。以下处置方法错误的是( )
| A.撤离污染区人员至安全地带,防止苯蒸气对人体造成危害 |
| B.切断电源,因为苯是一种易挥发、易燃物质,否则可能引起爆炸 |
| C.采用活性炭吸附地面液体 |
| D.由于现场比较空旷,采用点火焚烧的办法清除泄漏物 |