在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示: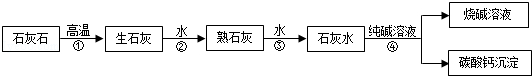
(1)在①﹣④四个过程中,发生了分解反应的是(填序号).
(2)检验烧碱溶液中含有少量
的具体方法是.
(3)在室温下,将53g质量分数为10%的
溶液与3000g澄清石灰水充分混合,恰好完全反应.则这时所得
溶液的质量是多少?(计算结果精确至0.1g)
2005年5月22日上午11时08分,中国登山测量队成功登上珠峰顶,这是继1975年后我国再次对珠穆朗玛峰高度进行精确测量。氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢氧化钙和氢气:CaH2+2H2O=Ca(OH)2+2H2↑,制取的氢气供燃烧之需。现有84克氢化钙与足量水反应,可生成氢气多少克?
在化学变化中,参加化学反应的物质总质量与生成物的总质量相等,且化学反应中各反应物与生成物之间的质量比是一定的。五中化学小组用加热氯酸钾与二氧化锰制取氧气,实验测得相关数据如下图所示:
(1)剩余的混合物中二氧化锰的质量为g,二氧化锰在反应中的作用是;
(2)反应生成氧气的质量为g。
(3)列式计算,求需要加热多少氯酸钾完全反应生成9.6 g氧气?
我县富含石灰石资源,为测定石灰石中碳酸钙的含量,取10.0克样品于烧杯中,再向其中加入稀盐酸50.0克,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7克。
(1)生成CO2的质量。
(2)求石灰石样品中碳酸钙的质量(写出计算过程)。
)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源,反应的化学方程式为:LiH+H2O=LiOH+H2↑。计算80g氢化锂与足量的水反应生成氢气的质量。
将2.34gNaCl固体溶于103.4g水中得到不饱和溶液,再向所得溶液中小心滴入200g AgNO3溶液.实验过程中,生成的AgCl的质量与滴入的AgNO3溶液的质量关系如图所示(提示:NaCl+AgNO3=AgCl↓+NaNO3).
(1)计算A点处生成NaNO3的质量?
(2)计算B点溶液中AgNO3的溶质质量分数。