在一密闭容器内有 、 、 、 四种物质,加热一段时间后停止反应,测得反应前后各物质的质量如下表所示,则下列说法中不正确的是()
| 物质 | ||||
| 反应前质量 | ||||
| 反应后质量 |
| A. | 等于 |
| B. | Y可能是催化剂 |
| C. | 继续加热至完全反应,还会有 物质 生成 |
| D. | 反应消耗或生成的 、 、 质量比为 |
人体健康离不开化学。下列叙述正确的是( )
| A.铁、锌、钙是人体所需的微量元素 |
| B.只要胃液的pH<7,人体就是健康的 |
| C.缺少铁元素会引起缺铁性贫血 |
| D.为防止龋齿,应在牙膏中添加大量的氟元素 |
下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是( )
A.煤炉内产生蓝色火焰的反应 :2C+O2 2CO化合反应 2CO化合反应 |
B.焦炭用于炼铁:3C+ Fe2O3  Fe + 3CO2↑置换反应 Fe + 3CO2↑置换反应 |
| C.检验二氧化碳:CO2+2NaOH=Na2CO3+H2O复分解反应 |
| D.用稀盐酸除去铁锈:Fe2O3+6HCl=2FeCl3+3H2O复分解反应 |
在日常生活中,下列做法不正确的是( )
| A.装食品用的聚乙烯塑料袋可用加热的方法封口 |
| B.用食盐水去除铁锅内的铁锈 |
| C.乡村井水浑浊时,向其中加明矾可以净水 |
| D.被蚊虫叮咬后涂肥皂水可以止痒 |
下列物质的用途错误的是( )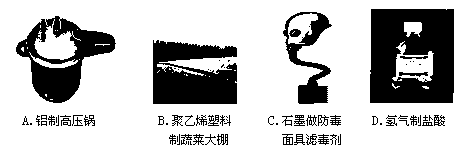
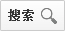
下列实验操作正确的是( )