为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是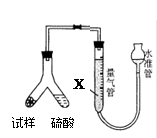
| A.可用稀盐酸代替稀硫酸 |
| B.量气管中液体为水 |
| C.反应完全后,冷却,读取量气管体积数,再减去所加硫酸的体积,即为生成的气体体积 |
| D.实验测得该试样中碳酸氢钠质量分数偏高,可能是测定气体体积时未冷却至室温 |
下列溶液一定呈中性的是 ( )
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
下列过程或现象与盐类水解无关的是()
| A.纯碱溶液去油污 |
| B.加热稀醋酸溶液其pH 稍有减小 |
| C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 |
| D.浓的硫化钠溶液有臭味 |
下列说法正确的是 ( )
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的稀溶液中不存在溶质分子 |
| C.强电解质都是离子化合物,而弱电解质都是共价化合物 |
| D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同 |
纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是 ( )
| A.食盐颗粒大一些有利于提纯 |
| B.设计实验的根据是MgCl2比NaCl易溶于水 |
| C.设计实验的根据是NaCl的溶解平衡 |
| D.在整个过程中,NaCl的物质的量浓度会变大 |
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。
H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是()
| A.反应开始时,反应速率:甲<乙<丙 |
| B.平衡时,甲中和丙中H2的转化率均是60% |
| C.平衡时,c(CO2)丙=2c(CO2)甲 |
| D.平衡时,乙中CO2的体积分数大于60% |