常温下,对下列四种溶液的叙述正确的是
| |
① |
② |
③ |
④ |
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.③、④两溶液相比,两者的KW相同
B.①、②两种溶液分别加水稀释100倍,pH变化较大的是①
C.等体积的③、④溶液中分别加入过量锌粒,产生的氢气前者大于后者
D.①、④ 两溶液按2: 1体积比混合后溶液中微粒浓度满足c(NH4+)+c(NH3·H2O)=c(Cl-)
在某容积一定的密闭容器中,有下列的可逆反 应:A(g) + B(g)
应:A(g) + B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是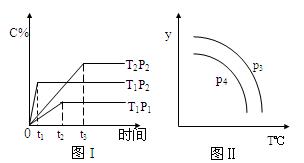
| A.P3>P4,y轴表示B的百分含量 |
| B.P3<P4,y轴表示B的体积分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
一定温度下,在固定体积的密闭容器中进行反应:N2+3H2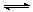 2NH3。该反应达到平衡的标志是
2NH3。该反应达到平衡的标志是
| A.3v(H2)正=2v(NH3)逆 | B.单位时间生成m mol N2的同时生成3m mol H2 |
| C.混合气体的密度不再随时间变化 | D.容器内的总压强不再随时间而变化 |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 | C.加少量冰醋酸 | D.加水 |
下列说法正确的是
| A.已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ,其ΔS>0 |
| B.已知反应X+Y= M+N为放热反应, X和Y的总能量一定高于M和N的总能量 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.对有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
反应A(g)+3B(g) 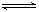 2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol / (L·s)B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s)D.υ(A)="0.15" mol / (L·s)