纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4  Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C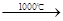 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3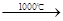 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________kg,此时消耗碳单质的量是原步骤②反应用碳量的____倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
| x |
y |
z |
| |
|
|
| |
|
|
| |
|
|
有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,灼烧后的残渣能与30.0mL盐酸恰好完全反应。试求:
(1)原混合物中各物质的质量。(2)所用盐酸的物质的量浓度。
取4.6g钠投入水中,完全反应后,溶液的体积为1L,问:(1)生成的气体体积在标准状况下为 多少升? (2)所得溶液溶质的物质的量浓度是多少?
多少升? (2)所得溶液溶质的物质的量浓度是多少?
平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐(含有结晶水),其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干 燥后重1.74g。请计算该试样中:
燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量;
(2)镁离子的物质的量;
(3)氢氧根离子和铝离子的物质的量;
(4)写出碱式碳酸盐的化学式。
某有机物A只含有C、H、O三种元 素,常用作
素,常用作 有机合成的中间体。现将8.4 g该有机物在13.44L(标况下)O2经充分燃烧后将产生的热气体(无有机物)先通过足量的CuSO4固体,发现该固体增重7.2g,然后再将该剩余气体通入足量的澄清石灰水,石灰水增重17.6 g;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1。
有机合成的中间体。现将8.4 g该有机物在13.44L(标况下)O2经充分燃烧后将产生的热气体(无有机物)先通过足量的CuSO4固体,发现该固体增重7.2g,然后再将该剩余气体通入足量的澄清石灰水,石灰水增重17.6 g;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1。
(1)通过计算确定该有机物A的分子式,并写出A的结构简式(要有计算过程)。
(2)有机物B是A的同分 异构体,1 mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。请写出B的结构简式是。
异构体,1 mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。请写出B的结构简式是。
有机物A由碳、氢、氧三种元素组成,现取3g A与 4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余),将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g,回答下列问题:
(1)3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
(3)已知A能和金属钠发生反应,则写出A可能的结构简式。