下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
|
a |
|
b |
|
| 3 |
c |
d |
e |
f |
|
g |
h |
|
| 4 |
J |
|
|
|
|
|
k |
|
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是( )
A.单质熔点: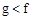
B.最高价氧化物对应水化物的酸性: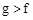
C.最高价氧化物对应水化物的溶解性: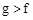
D.f不能与氢气反应,g能与氢气反应
下列说法正确的是()
| A.阿伏伽德罗常数约为6.02×1023 |
| B.物质的量是一个基本物理量,表示物质所含粒子的多少 |
| C.H2O的相对分子质量是18,1mol水的质量也是18 |
| D.不同条件下,1mol任何气体所含分子数均相同 |
联苯( )由两个苯环通过单键连接而成。假定二氯联苯分子中,苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有
)由两个苯环通过单键连接而成。假定二氯联苯分子中,苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有
| A.6种 | B.9种 | C.10种 | D.12种 |
下列物质的分类正确的是
①混合物:氯水、氨水、水玻璃、水银;②电解质:明矾、冰醋酸、石膏、石炭酸;
③非极性分子:CO2、CCl4、CH2C12、对二甲苯;④同位素:1H+、2H-、2H2、2H3H;
⑤同素异形体:C60、C80、金刚石、石墨;⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2;
⑦同分异构体:乙二酸乙二酯、乙二酸二乙酯、二乙酸乙二酯。
| A.②⑤ | B.②④⑤⑦ | C.②⑤⑥⑦ | D.全部 |
以CnHmCOOH所表示的羧酸0.1mol与碘加成时,消耗碘单质50.8g,取同量该酸完全燃烧生成水和二氧化碳共3.4mol,则该羧酸是
| A.C15H31COOH | B.C17H35COOH | C.C15H27COOH | D.C17H31COOH |
最近科学家公布了新合成的一种烯烃,始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
| A.始祖鸟烯与乙烯互为同系物 |
| B.若R1=R2=CH3,则其化学式为C12H16 |
| C.若R1=R2=CH3,则始祖鸟烯的一氯代物有3种 |
| D.始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的 |