向Cu和Cu2O的混合物27.2g中加入某浓度的硝酸0.1L,固体物质完全反应,生成NO2、 N2O4、NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,溶液恰好呈中性,金属离子也已完全沉淀,沉淀质量为39.2g。以下所得结论不合理的是
| A.硝酸的物质的量浓度为12.0mol/L |
| B.产生的气体在标准状况下的体积为13.44L |
| C.Cu与Cu2O 的物质的量之比为2:1 |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
某学生用量筒量取液体、量筒放平稳且面向刻度线、初次仰视液面读数为19mL倾出部分液体后,俯视液面,读数是11mL则实际倾出液体的体积是()
| A.8ml | B.大于8mL | C.小于8mL | D.无法判断 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图。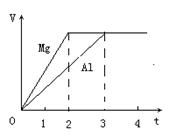
反应中镁和铝的()
| A.物质的量之比为3︰2 | B.质量之比为3︰2 |
| C.摩尔质量之比为2︰3 | D.以上都不对 |
下列离子方程式,书写正确的是()
| A.铁和稀盐酸反应 2Fe+6H+===2Fe3++3H2↑ |
| B.硝酸银溶液中加入铜粉 Ag++Cu===Cu2++Ag |
| C.氧化铜与盐酸反应 O2― +2H+ ===H2O |
D.碳酸镁跟稀硫酸反应:MgCO3+2H+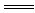 Mg2++H2O+CO2↑ Mg2++H2O+CO2↑ |
在甲乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是()
| A.Cu2+、H+、Cl- | B.Cl-、C O32-、OH- O32-、OH- |
C.K+、H+、Cl- | D.K+、OH-、CO32- |
科学家刚刚发现了某种元素的原子,其质量是a g ,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A.W g该原子中含有aNA该原子 | B.由已知信息可得:NA= |
| C.该原子的摩尔质量是aNA | D. W g该原子的物质的量一定是mol |