氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:_________→___________(填化学式)。
该反应的氧化产物是____________(填化学式);所得混合气体的平均式量为_______。
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为____________________________。若将该反应设计成原电池,则在正极生成的离子是___________(填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是_________(填序号)。
a. KMnO4> Cl2 b. Cl2> O2 c. HIO4> HClO3 d. HIO4> Cl2
已知工业上真空炼铷的反应方程式如下:2RbCl+Mg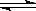 MgCl2+2Rb(g),对此反应能够进行的正确解释是( )
MgCl2+2Rb(g),对此反应能够进行的正确解释是( )
| A.铷比镁的金属性强 |
| B.铷的沸点比镁低,把铷的蒸气抽走后,平衡向正反应方向移动 |
| C.MgCl2的热稳定性比RbCl弱 |
| D.高温下Mg2+得电子能力比Rb+弱 |
金属锂是密度最小的金属,等质量的金属,锂可以释放出更多的电子,故常用来制造高性能电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法是( )
| A.电解法 | B.热还原法 | C.热分解法 | D.铝热法 |
实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
| A.Fe2O3和MnO2 | B.MnO2和V2O5 |
| C.Cr2O3和V2O5 | D.Fe3O4和FeO |
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
| A.Mg | B.Cu | C.Ag | D.H2 |
下列说法中正确的是( )
A有些活泼金属如铝可作高温还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物