下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯净物的是
| A.向FeSO4溶液中通入Cl2 |
| B.向KI和NaBr混合溶液中通入Cl2 |
| C.向NaAlO2溶液中加入HCl溶液 |
| D.向NaHCO3溶液中加入Na2O2粉末 |
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则()
| A.被氧化的砒霜为1.98mg |
| B.分解产生的氢气为0.672ml |
| C.和砒霜反应的锌为3.90mg |
| D.转移的电子总数为6×10―5NA |
向含1 mol NaOH、2 mol NaAlO2、1 mol Ba(OH)2的混合液中加入稀硫酸充分反应,加入溶质H2SO4的量和生成沉淀的量的关系正确的是()
| 选项 |
A |
B |
C |
D |
| n(H2SO4)/mol |
2 |
3 |
4 |
5 |
| n(沉淀) /mol |
2 |
3 |
2 |
1.5 |
已知:将C12通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且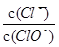 的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是()
的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是()
| A.改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol |
| B.改变温度,产物中NaCl的最小理论产量为4amol |
| C.参加反应的氯气的物质的量3amol |
D.某温度下,若反应后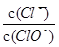 =6,则溶液中 =6,则溶液中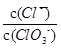 = =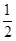 |
向等物质的量浓度的NaOH和Ca(OH)2的混合液中通入一定量CO2。下列离子方程式与事实不相符的是()
| A.OH-+CO2 → HCO3- |
| B.2OH-+CO2 → CO32-+H2O |
| C.Ca2++2OH-+CO2 → CaCO3↓+H2O |
| D.Ca2++4OH-+2CO2 → CaCO3↓+CO32-+2H2O |
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq) I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态)。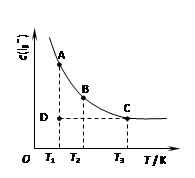
下列说法正确的是()
A.该反应的正反应为放热反应
B.A状态与C状态的化学反应速率大小为v(A)>v(C)
C.D状态时,v正>v逆
D.欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中