铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。
根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4 [ 已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s) g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(4)有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+ · Fe3+[ Fe3+(1-x) · Cr3+x · O4]。向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况)。计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量。
②所得气体中NO、NO2的体积比。
下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=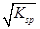
③将0.1mol·L-1的NaHS和0.1mol·L-1 Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
| A.①④ | B.②③ | C.③④ | D.①② |
下列实验能达到目的的是
 |
 |
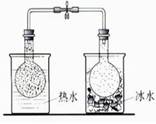 |
 |
| 用酒精萃取溴水中的溴 |
将硫酸铜溶液直接蒸干得到胆矾 |
说明2NO2(g)  N2O4(g)△H<0 N2O4(g)△H<0 |
实验室制备Fe(OH)2 |
| A |
B |
C |
D |
X、Y、Z、W是前20号元素,原子序数依次增大。X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫。下列说法错误的是
| A.X、Y形成的化合物中可能含有双键 |
| B.X单质和Z单质在暗处能剧烈反应 |
C.W元素与Z元素形成的化合物用电子式表示形成过程为: |
| D.XZ的沸点在与Z同族的其它X的化合物中最高 |
下列说法错误的是
| A.实验室用自来水制蒸馏水过程中,应弃去开始馏出的部分液体 |
| B.按照分散质和分散剂所处的状态,可分为9种分散系 |
| C.甲基丙烯酸甲酯能发生加成、水解、氧化等反应 |
| D.乙酸乙酯在碱性条件下水解称为取代反应或者称为皂化反应 |
利用下列表格中的器材和试剂能够完成相应实验的一组是
| 选项 |
实验器材和试剂 |
相应实验 |
| A |
洗气甁(两只)、饱和Na2CO3溶液、浓硫酸 |
出去CO2中的HCl和水蒸汽 |
| B |
滴定台(附滴定夹)、滴定管(酸式、碱式)、烧杯、胶头滴管 |
中和滴定实验 |
| C |
烧杯、酒精灯、火柴、胶头滴管、蒸馏水、FeCl3饱和溶液 |
制备Fe(OH)3胶体 |
| D |
铂丝或铁丝,蓝色钴玻璃、酒精灯、火柴、盐酸、待测液 |
焰色反应实验 |