(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
取1.43g Na2CO3·xH2O 溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0m L,并收集到112m LCO2(标准状况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·XH2O 的摩尔质量(3)x值
把19.2 g 的Cu放入500mL 2 mol∙L−1稀硝酸中,充分反应,Cu完全溶解。求:
(1)写出Cu与稀硝酸反应的离子方程式:;
(2)转移电子数目为(用含NA的式子表示);
(3)氧化剂与还原剂的物质的量比为。
(4)反应后溶液中C(H+)为(体积变化忽略不计)
在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的氢气时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质 量是多少?
(2)通过导线的电子的物质的量是多少?
(3)原稀硫酸的物质的量浓度是多少?
已知NaCl(s)+H2SO4(浓)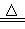 NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:
NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于100g水中,若所得盐酸的密度为1.1 g/mL,则盐酸的物质的量浓度为多少?
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,求这时A的转化率。
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,求这时A的转化率。