碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应
式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是:
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
下列离子方程式的书写正确的是( )
| A.向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4+ |
| B.晶体硅溶于烧碱溶液:Si+2OH-+H2O=SiO32-+2H2↑ |
| C.向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D.向FeBr2溶液中滴加足量的氯水:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
某澄清溶液可能含有K+、Al3+、Mg2+、NH4+、Fe2+、Fe3+、Cu2+、SO42-、CO32-中的一种或几种,为确定其成分,进行如下实验:①取部分溶液,逐滴滴入用HCl酸化的BaCl2溶液,产生白色沉淀;②另取部分溶液,缓慢加入足量的Na2O2固体并加热,产生无色无味的气体,同时产生白色沉淀后白色沉淀部分溶解。下列推断正确的是( )
| A.肯定有Al3+、SO42-,可能有K+、NH4+ |
| B.肯定无Fe2+、Mg2+、CO32-,可能有Al3+ |
| C.原溶液一定是明矾和MgSO4的混合溶液 |
| D.不能确定的离子只能通过焰色反应来确定 |
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是( )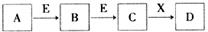
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D在常温下可与Cu反应生成B或C
向NaBr、NaI、Na2SO3混合液中,通入一定量Cl2后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
| A.NaCl、Na2SO3、Na2SO4 | B.NaCl、NaBr、Na2SO4 |
| C.NaCl、NaBr、I2 | D.NaCl、NaI、Na2SO3 |
工业上用铝土矿(主要成分为Al2O3,杂质为Fe2O3和SiO2)为原料冶炼铝的工艺流程之一为: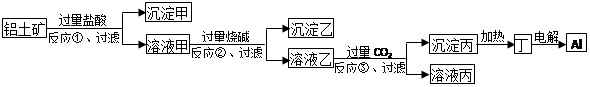
下列叙述不正确的是( )
| A.沉淀甲为SiO2 |
| B.生成沉淀乙的反应为:Fe3++3OH-=Fe(OH)3↓ |
| C.溶液乙中含有AlO2- |
| D.反应③为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |