铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。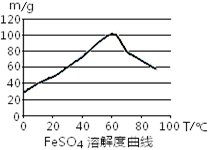
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为 。若要提高FeSO4生成速率,采取下列措施中正确的是 。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+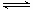 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是 。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行 、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: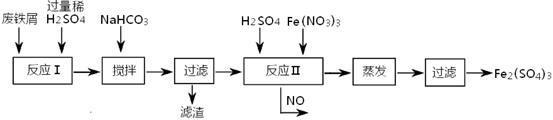
①加入NaHCO3并搅拌,将混合液pH调控至 范围内,使杂质沉淀过滤除去。
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Cu(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
4.7 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
6.7 |
②反应Ⅱ中反应的离子方程式是: 。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是 ,气体X与NO配比的比例是 。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是 。
根据如图所示装置回答: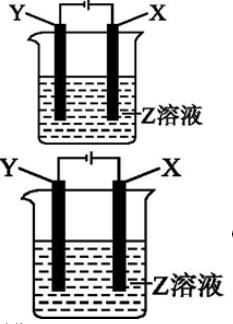
(1)当X为Pt, Y为Fe, Z为AgNO3时,阳极反应为 ,阴极反应为
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
(3)用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为 mol/L
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH1=+489.0 kJ·mol-1;
C(石墨)+CO2(g)==="2CO(g)" ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3(s)的热化学方程式为________________________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为
CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH
CH3OH(g)+H2O(g)ΔH
①该反应的平衡常数表达式为K=_____________。
②取一定体积的CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图Z76(a)所示,则该反应的ΔH________0(填“>”“<”或“=”)。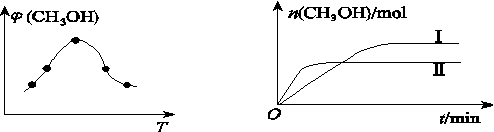
(a) (b)
图Z76
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间的变化关系如图(b)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI________KⅡ(填“>”“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为:____________
2NH3+CO2  CO(NH2)2+H2O当氨碳比
CO(NH2)2+H2O当氨碳比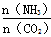 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为________。
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开活塞E后,C中溶液颜色变化为 ,烧瓶中发生反应的化学方程式为 。
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是 ,固体的主要成分为(写化学式)_________________。
(3)利用上述装置可以验证SO2的性质, 若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有 溶液时可验证其具有漂白性;而C中盛有 溶液时可验证其具有还原性(各填一种物质名称)。
某同学设计了有关氯气的实验: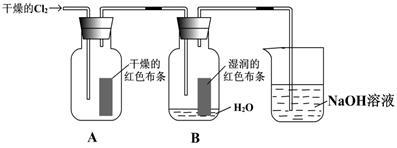
(1)写出实验室制备Cl2的离子方程式,并用单线桥分析电子的转移: 。
(2)装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条 ,用发生反应的化学方程式和必要的文字叙述解释现象 。
(3)上述装置烧杯中盛放溶液的作用是_________________________。
(4)Fe在Cl2中燃烧,生成棕红色的烟,其溶液中存在Fe3+,向溶液中加入适量量铜粉恰好完全反应,溶液变色,发生的化学反应方程式为 ,后再加氯水,溶液颜色再次发生变化,原因是(用离子方程式表示)_____________。
(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)在下列提供的试剂中,选择合适的试剂除去下表中各混合物的杂质(括号内物质为杂质),并按要求填写空格。
| A.NaOH溶液 | B.稀盐酸 | C.氯水 | D.溴水 |
| 混合物(括号内为杂质) |
除杂试剂(填序号) |
反 应 离 子 方 程 式 |
| ① Cu (CuO) |
||
| ② NaBr (NaI) |