下列关于离子检验的说法中,正确的是
| A.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有C1- |
| B.向某溶液中加入稀盐酸,产生无色气体,则该溶液中一定含有CO32- |
| C.向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- |
| D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca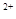 +2ClO +2ClO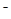 =CaCO3↓+2HClO =CaCO3↓+2HClO |
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO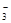 =CO =CO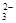 +H2O +H2O |
C.Fe3O4与稀HNO3反应:Fe3O4+8H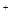 =Fe =Fe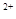 +2Fe +2Fe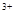 +4H2O +4H2O |
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO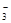 +Ca +Ca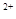 +OH +OH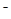 =CaCO3↓+H2O =CaCO3↓+H2O |
分类思想是学习化学的重要思想,从分类的角度分析正确的是
| A.SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B.Na2O和NH3的水溶液均能导电,故均为电解质 |
| C.Si和SiO2均属于原子晶体 |
| D.Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |
水是生命之源,下列关于水的说法正确的是
| A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| B.某温度下,pH=6的蒸馏水显酸性 |
| C.氯气有毒,因而自来水的杀菌消毒一定不能使用氯气 |
| D.明矾可用于水的净化与杀菌消毒 |
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是()
| A.反应后的固体混合物中Cu的质量为12.8 g |
| B.反应后的固体混合物中还含有碳 |
| C.反应后的固体混合物总质量为13.6 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol |
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO2- 3、SO2- 3、CO2- 3、SO2- 4中的若干种离子。某同学对该溶液进行了如下实验:
下列判断错误的是()
| A.气体甲可能是混合物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.白色沉淀乙的主要成分是氢氧化铝 |
| D.K+、AlO2-和SiO2- 3一定存在于溶液X中 |