某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。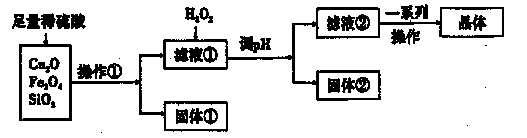
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是 。
I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸,模拟该生产过程如下:
(1)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜有关反应的离子方程式____________
(2)如图,组装好仪器,通电约25min。在阳极生成氧化铝,阴极产生气体。则该过程中阳极发生反应的电极式为______;该溶液pH的变化______(填:“增大”或“减小”或“不变”)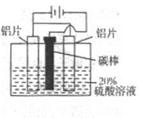
II现代社会对电池的需求越来越大,尤其足可充电的二次电池。
髙铁电池是一种新型可充电电池,总反应为:3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
氮及其化合物在工农业生产、生活中有者重要作用。请回答下列问题: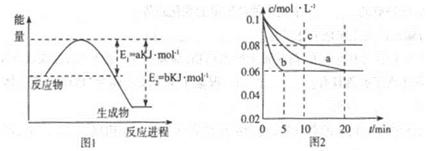
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能星变化示意图(a、b均大于0,)且知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ·mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式____________;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①计算在a达平衡时H2的转化率为______;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是______;
试写出判断b与a条件不同的理由____________;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如下表:
①试确定K1的相对大小,K1______4.1x106(填写“>”“-”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是______(填序号字母)。
A.容器内NH3的浓度保持不变 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)______。
②250C时,将pH=x氨水与pH=y的疏酸(且x+y=14,x>11)等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.[SO42-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[SO42-]>[OH-]>[H+]
C.[NH4+]+[H+]>[OH-]+[SO42-]
D.[NH4+]>[SO42-]>[H+]>[OH-]
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素, F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素。回答下列问题:
(1)写出E、F、G的元素符号,B、C、D元素的第一电离能由大到小的顺序是(用元素符号表示),A元素分别与B、D元素形成的二种微粒都具有NH3相似的结构,属于等电子体,它们的化学式是。
(2)F元素的原子基态价层电子排布图是。
(3)向G的硫酸盐溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[G(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过________键与中心离子G2+结合;NH3分子中N原子的杂化方式是________;
(4)E单质晶体中原子的堆积模型如右图,晶胞是图中的(填a、b或c);配位数是;若紧邻的四个E原子的中心连线构成的几何体的体积是a cm3,E单质的密度为ρg/ cm3;则E的相对原子质量的计算式是。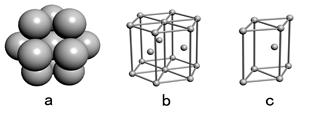
(1)下列关于工业生产说法正确的是。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH |
Ca2+、Mg2+总浓度 |
细菌总数 |
| 6.5~8.5 |
< 0.004 5 mol·L-1 |
<100个·mL-1 |
以下是原水处理成自来水的工艺流程示意图:
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):;。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成沉淀;通入二氧化碳的目的是和。
③气体A的作用是,下列物质中可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
化学物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下:
(1)反应①的类型为:,反应④的类型为:。
(2)物质F中含氧官能团的名称为。
(3)反应③会生成与D互为同分异构体的副产物,该反应的方程式为。
(4)若未设计反应⑥,则化合物I中可能混有杂质,该杂质同样含有一个六元环和两个五元环,其结构简式为。
(5)写出同时满足下列条件的物质I的一种同分异构体的结构简式。
①能发生银镜反应;②能发生水解反应;③分子的核磁共振氢谱有5个峰。
(6)已知:
以 、
、 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用)。合成流程图示例如下:
,写出合成流程图(无机试剂任用)。合成流程图示例如下: