根据下图可以写出热化学方程式As2O5(s) = As2O3( s) +O2( g) △H =" a" kJ/mol。则a为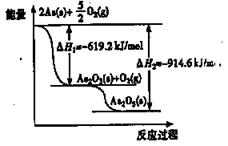
| A.+1533.8 | B.— 1533.8 | C.+295.4 | D.—295.4 |
下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
| 编号 |
金属(粉末状) |
酸的浓度 |
酸的体积 |
反应温度 |
| A |
0.1mol Mg |
6mol/L硝酸 |
10mL |
30℃ |
| B |
0.1mol Mg |
3mol/L盐酸 |
10mL |
60℃ |
| C |
0.1mol Fe |
3mol/L盐酸 |
10mL |
60℃ |
| D |
0.1mol Mg |
3mol/L盐酸 |
10mL |
30℃ |
下列有关物质应用的叙述中,不正确的是
| A.氢氧化铝可用于治疗胃酸过多 | B.ClO2用于饮用水消毒 |
| C.水玻璃浸泡过的木材既能防腐又能耐火 | D.Si用于制造光导纤维 |
下列离子方程式书写正确的是
| A.铜跟稀硝酸反应:3Cu+ 8H++2NO3-=3Cu2++2NO↑+4H2O |
| B.实验室用大理石和稀盐酸制取CO2:2H+ + CO32-=CO2↑+ H2O |
| C.金属铁与稀硫酸反应:2Fe+6H+=2Fe3+ + 3H2↑ |
| D.钠与水反应: Na+H2O=Na++OH-+H2↑ |
下列表示物质结构的化学用语或模型正确的是
A.苯分子的比例模型: |
B.CO2的电子式: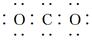 |
C.Cl-离子的结构示意图: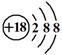 |
| D.乙烯的结构式:CH2=CH2 |
下列有关实验的说法正确的是


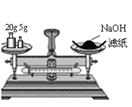
A B C D
| A.加热后溶液颜色变为无色 | B.配制100 mL 0.10 mol·L-1NaCl溶液 |
| C.实验室用该装置制取少量蒸馏水 | D.称量25 g NaOH |