一定条件下,氨气和氟气发生反应:4NH3 + 3F2 → NF3 + 3NH4F,其中产物NF3分子结构和NH3相似。下列有关说法错误的是
| A.NF3分子呈三角锥形 |
| B.NF3分子是极性分子 |
| C.NF3与NH3晶体类型相同 |
| D.上述反应中,反应物和生成物均属于共价分子 |
某烃的分子式中含有一个苯环,两个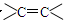 和一个—C≡C—,则它的分子式可能为
和一个—C≡C—,则它的分子式可能为
| A.C9H12 | B.C17H20 | C.C20H30 | D.C12H20 |
在20世纪末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。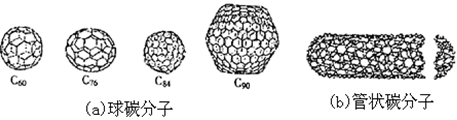
下列有关碳元素单质的说法错误的是
| A.金刚石的熔点肯定要比C60高 |
| B.金刚石的硬度肯定要比C60大 |
| C.球碳分子,管状碳分子、洋葱状碳分子,都是分子晶体,都是碳的同素异形体 |
| D.金刚石属原子晶体,管状碳分子属分子晶体,它们不是同素异形体。 |
下列说法中,正确的是
| A.离子化合物中一定不含共价键,共价化合物中一定不含离子键 |
| B.水分子呈直线形,氨分子呈三角锥形 |
| C.碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键 |
| D.分子间作用力越大,分子的热稳定性就越大 |
一定温度下,将 3 mol SO2和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g) + O2(g) 2SO3(g);△H= -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g);△H= -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是
| A.生成 SO3为2 mol |
| B.放出 197 kJ 的热量 |
| C.SO2和 SO3 物质的量之和一定为 3 mol |
| D.SO2的物质的量和SO3 物质的量一定相等 |
砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是
| A.砷在通常情况下是固体 | B.可以存在-3、+3、+5等多种化合价 |
| C.As2O5对应水化物的酸性比H3PO4弱 | D.砷的还原性比磷弱 |