一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是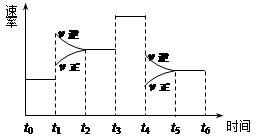
| A.t0→t1 | B.t2→t3 | C.t3→t4 | D.t5→t6 |
印尼默拉皮火山于2010年10月30日凌晨再度喷发,产生大量的火山气和火山灰,下表所列的是印尼气象部门对默拉皮火山周围大气某次检测得到的数据
| 污染物 |
二氧化硫 |
二氧化氮 |
可吸入颗粒物 |
| 污染指数 |
105 |
23 |
203 |
该次检测中,默拉皮火山周围的空气污染指数为
A.105 B.128C.203 D.331
两种气态烃的混合物共0.1 mol ,充分燃烧后得3.58 L(标准状况下)CO2和3.6 g水,下列说法正确的是
| A.一定有甲烷 | B.一定有乙烯 | C.可能有乙烷 | D.无法计算 |
某醇与足量的金属钠反应,产生的氢气与醇的物质的量之比为1:1,则该醇可能是
| A.甲醇 | B.乙醇 | C.乙二醇 | D.丙三醇 |
某有机物完全燃烧时只生成水和二氧化碳,且两者的物质的量之比为3:2,则
| A.该有机物含碳、氢、氧三种元素 |
| B.该化合物是乙烷 |
| C.该化合物分子中碳、氢原子个数之比是2 :3 |
| D.该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式如下图所示,下列关于咖啡酸的说法中,不正确的是
| A.1mol咖啡酸在一定条件下可和4mol氢气加成 |
| B.属于芳香烃 |
| C.咖啡酸的分子式为C9H10O2 |
| D.既能和浓溴水反应,也能和酸性高锰酸钾溶液反应 |